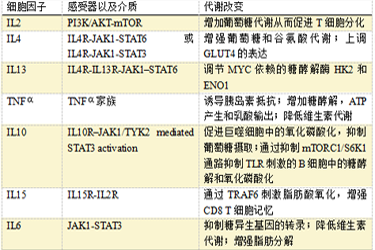
日前,从复旦大学附属肿瘤医院传来消息,该院胡夕春教授、王碧芸教授、陈光亮教授团队首次发现脂肪细胞对三阴性乳腺癌铁死亡的保护作用。
研究证实,与肿瘤周围脂肪细胞共培养的乳腺癌细胞显示出对铁死亡的抵抗,进一步实验发现脂肪细胞可以通过分泌特定的脂肪酸诱导乳腺癌细胞产生铁死亡抵抗,并且该过程依赖于脂肪酸合成酶ACSL3。研究团队还通过动物模型验证了脂肪细胞对三阴性乳腺癌的铁死亡保护。相关成果在《血液和肿瘤学杂志》在线发表。
三阴性乳腺癌逃避细胞死亡原因待解
通常情况下,乳腺癌是肿瘤中预后较好的类型,然而约占所有乳腺癌15%的三阴性乳腺癌则因恶性程度较高,转移复发风险大,缺乏相应靶点,治疗效果差而被称为“最毒”乳腺癌。
铁死亡是新近发现的程序性细胞死亡方式,三阴性乳腺癌更具侵袭性及治疗耐受性的重要原因之一是对各类细胞死亡的逃避,而目前还没有三阴性乳腺癌逃避铁死亡的研究报道。
乳腺处于大量脂肪细胞浸润的独特微环境中,而先前有研究表明脂肪细胞可以调控乳腺癌的脂肪酸代谢,并增强乳腺癌的侵袭转移能力,而铁死亡与脂肪酸代谢密切相关,因此研究者提出科学假设,脂肪细胞是否参与调控乳腺癌的铁死亡?
首次发现脂肪细胞对三阴性乳腺癌铁死亡的保护
团队在前期研究中发现,数据库显示乳腺癌对铁死亡整体敏感性较低,而脂肪细胞与铁死亡相关基因有密切的关联。脂肪细胞与乳腺癌的发生发展密切相关,是否也参与到铁死亡的调控?
脂肪细胞对三阴性乳腺癌铁死亡的保护
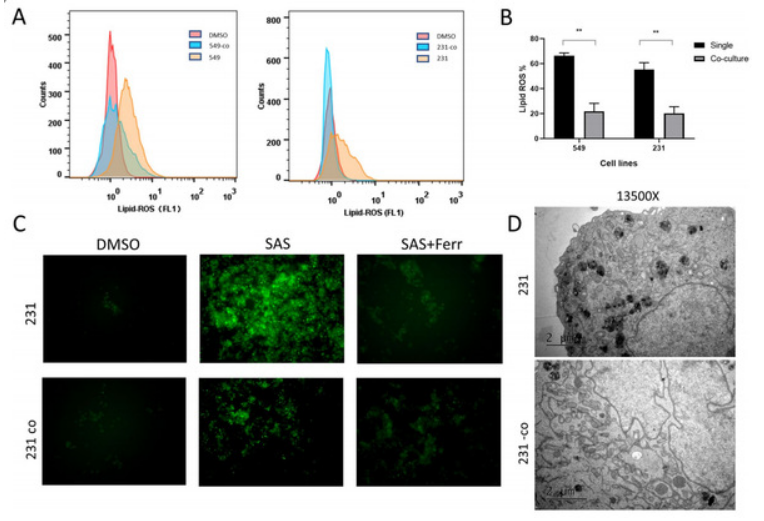
研究者随后构建了乳腺癌-脂肪细胞共培养体系,并使用不同的铁死亡诱导剂,检测乳腺癌的铁死亡水平,结果证实共培养细胞对铁死亡显著抵抗,且可被铁死亡抑制剂所逆转,而不能被凋亡等其他细胞死亡抑制剂所逆转。同时,从蛋白表达、电镜、细胞增殖等多个角度验证了结果。进一步地,研究团队为了模拟乳腺癌在体内脂肪的真实微环境,构建了小鼠模型并证实了脂肪细胞对三阴性乳腺癌体内对铁死亡的保护。
揭示脂肪细胞调控乳腺癌铁死亡的机制
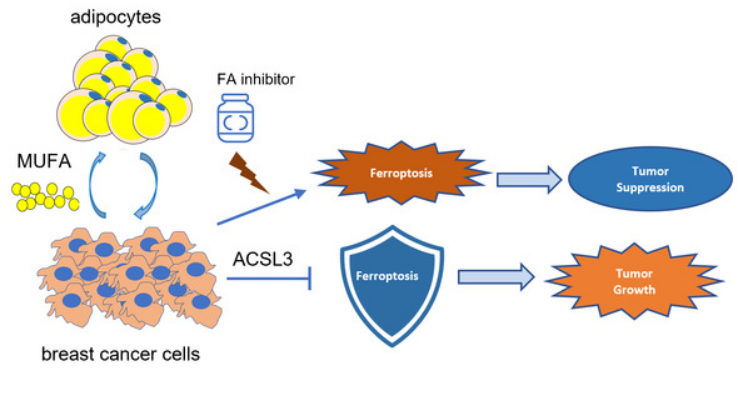
脂肪细胞通过何种机制调控乳腺癌铁死亡?研究者接着对共培养和单独培养细胞进行了脂质组学分析,发现共培养细胞中磷脂合成通路显著升高,后续使用外源性脂肪酸及脂肪酸摄取抑制剂等方法探索并找到了脂肪细胞通过分泌脂肪酸MUFA调控乳腺癌细胞铁死亡。
脂肪细胞对三阴性乳腺癌铁死亡保护的机制示意图
查阅文献及预实验证实MUFA通过脂肪酸合成相关的酶类ACSL3结合到磷脂上,因此后续进行了ACSL3的敲减实验并证实脂肪细胞和外源性MUFA对乳腺癌铁死亡的调控依赖于ACSL3。
逆转铁死亡保护:抑制脂肪酸代谢或成破局的关键
本研究首次发现脂肪细胞在调控三阴性乳腺癌铁死亡中的关键作用并揭示了其机制,完善了学界对乳腺癌微环境和铁死亡关系的认识,并提供了未来的潜在治疗靶点。
课题组在后续工作中也发现特定的药物可以有效逆转脂肪细胞对乳腺癌的铁死亡保护,其过程可能通过抑制脂肪酸代谢来实现,相关验证工作还在进行中。未来有望通过两药联合的方式诱导三阴性乳腺癌铁死亡从而实现缩减肿瘤的目的。







 《健康云南行动(2020-2030年)》 政策解读
《健康云南行动(2020-2030年)》 政策解读 健康中原行动实施方案确定
健康中原行动实施方案确定












 绿茶到底是致癌还是防癌?研究给出了答案!
绿茶到底是致癌还是防癌?研究给出了答案!