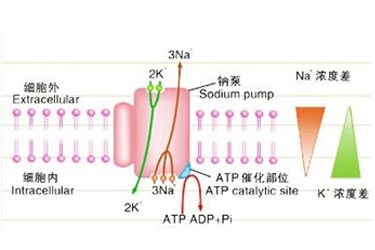
水是细胞和细胞间隙的主要成份,细胞内外一切生命活动都是在水的微环境中进行,在消化、呼吸、循环、体温调节、毒素的清除以及神经内环境稳定等多种机体活动中都存在水的跨细胞膜转运。水通道蛋白(aquaporins,AQPs)是对水专一的通道蛋白,普遍存在于动、植物及微生物中。它所介导的自由水快速被动的跨生物膜转运,是水进出细胞的主要途径。到目前为止已克隆的哺乳动物水通道家族有11个成员(AQP0-AQP10),其基因结构、基因表达调控、染色体定位、蛋白结构、组织分布和生理功能得到了较为深入的研究。
AQP是一种糖蛋白,分子量约30kD左右,属古老的跨膜通道蛋白MIP(major intrinsic protein)家族成员。AQP的一级结构为跨越细胞膜6次的单肽链,其氨基和羧基末端均位于细胞内,含3个胞外环(A,C,E)和2个胞内环(B,D),同源性最高的是位于B环和E环上的天冬酰氨-哺氨酸-丙氨酸(Asn-Pro-Ala,NPA)基元,NPA是AQP家族成员共有的特征性结构。AQP的三级结构呈沙漏模式(hourglass),允许水分子(H20)自由通过,而不允许水质子(H3O+)通过。
AQPs是具有高度选择性的水通道特异蛋白质家族,种类多,在机体中的分布也较广泛。哺乳动物AQP迄今为止已发现11种(AQP0-AQP10)。根据AQP对水和其它溶质的通透性,将AOP家族分为两个族:大部分AQPs为高度选择性水通透性,即除水之外不转运其它小分子溶质,称为classicaquaporins。AQP3,AQP7,AQP9,AQP10属于相对选择性水通透性,即对水和其它小分子溶质如甘油等均有通透性,称为aquaglyceroporins。另外根据AQP功能能否被汞剂所抑制而分为汞敏感性水通道蛋白和汞不敏感性水通道蛋白。在已知的十种水通道蛋白中,只有AQP4和AQP7为汞不敏感性水通道蛋白。近年来有关AQPs与肿瘤关系的研究也成为热点。
恶性肿瘤最基本的生物学特征是肿瘤组织的无限增殖和肿瘤细胞的分化异常。肿瘤增殖、侵袭和转移是一个高度选择性的过程,其依赖于肿瘤特性和它们周围独特的微环境之间的复杂反应,为满足快速增殖、分裂和侵袭转移的需要,癌细胞比正常细胞更需要水分子的快速跨膜转运,多数肿瘤有很高的组织间隙液体压力和很高的微血管渗透性。最新的观点认为AQP具有致癌特性,AOP全长cDNA(complementary deoxyribonucleic acid,cDNA)的异位表达引起许多表现型的改变,包括细胞增殖活性加强,非依赖生长的增殖细胞固定等。表达AQPs的肿瘤细胞在体外表现为较强的迁移能力,在体内则表现为局部侵袭能力增强、渗出增多。因此研究AQPs在肿瘤中的表达和分布具有重要意义。
目前大量研究证实,许多肿瘤组织、细胞系及肿瘤微血管内皮细胞中高度表达AQP1。AQP1可以使肿瘤血管渗透性增加,促进水在肿瘤细胞间的快速转运,促进肿瘤血管生成。有报道AQP1在肺腺癌组织中表达增高,提示AQP1可能与肺腺癌的发生和发展密切相关;AQP1主要表达于子宫颈癌组织间的血管内皮细胞,其表达量较微血管密度低,并与微血管共同在子宫颈癌的生长、侵袭和转移中起重要作用;
AQP1在前列腺癌组织中表达,主要分布在肿瘤组织血管内皮细胞,增加肿瘤上皮和血管对水的通透性运输,从而促进肿瘤的生长及向周围基质浸润;AQP1在骨肉瘤的体积较大、形状不规则的细胞膜上大量表达,而在体积较小的肿瘤细胞上AQP1无表达或表达较弱;AQP1可能在食管癌肿瘤形成和发展的过程中发挥着重要的作用;在有淋巴结转移的喉癌组织中AQP1高表达,并且AQP1的表达随肿瘤临床分期的增高而逐渐升高,组织分化程度越差,AQP1的表达越高;AQP1在乳腺癌组织中表达增高,提示AQP1可能与乳腺痛生长、转移有关;国内有报道鼻咽组织中AQP1存在明确表达,在非肿瘤组织及未发生转移的肿瘤组织中,其主要表达于组织间质的血管内皮细胞膜上,而在发生转移的肿瘤组织中其表法量增加,并且在肿瘤细胞的细胞膜上发现其表达。关于AQP1存与肿瘤的作用机制,目前可归纳为以下两个方面:一方面是AQP1可以使肿瘤血管渗透性增加,促进水在肿瘤细胞间的快速转运,促进肿瘤血管生成,增强肿瘤的侵袭和转移能力。另一方面是AQP1本身的致癌性,AQP1基因的多样性本身即可引起肿瘤。
除了AQP1之外,其他水通道蛋白与肿瘤的研究也有报道。AQP3与食管癌组织转移和组织学分化有一定关系;AQP3在人肺腺癌组织中高表达,并且这种高表达与肿瘤分化和腺癌临床分期有关,提示AQP3在肿瘤细胞增殖、侵袭和转移中有重要作用。AQP4在脑胶质瘤星形胶质细胞和血管内皮细胞中的表达明显高于正常组织,AQP4与脑胶质瘤组织的血管形成、转移密切相关;AQP4可能还与人大肠癌肿瘤细胞浸润、转移有关;AQP4可在部分晚期胃癌组织中表达增加。Moon等研究表明AQP1,3,5在大肠腺癌表达提高;实验证实AQP1和AQP4均可加速中国Hamster卵巢细胞和Fisher鼠甲状腺细胞的迁移。而AQP3在结肠癌、乳腺癌、卵巢癌、肺癌、胃癌、慢性粒细胞性白血病中存在高表达,并参与肿瘤的发生、发展、分化、侵袭和转移以及凋亡等生物学过程。AQP8的表达可能与子宫颈癌的发生、发展和转移有关。AQP9在卵巢上皮性肿瘤组织中的表达均上调。
AQPs在肿瘤血管发生、肿瘤细胞迁移和增殖过程中所发挥的作用具有重要的临床意义。首先,它对AQP在肿瘤细胞和肿瘤微血管中的表达以及肿瘤侵袭性和AQP表达之间的关系提供了合理解释。其次,它对评估AQP抑制剂的作用提供了合理的理论支持,如果有效,它可以降低肿瘤血管生成和肿瘤扩散,从而治疗肿瘤。
参考文献:
1.Vokman As. More than just water channels: unexpected cellular roles of aquaporins.J Cell Sci,2005118(Pt 15):S3225-S3232.
2.Jeyaseelan K, Sepramaniam S, Armugam A,et al. Aquaporins: a promising target for drug development.Expert Opin Ther Targets,2006,10(6):889-909.
3.Moon C,Soria JC,Jang AJ,et al. Involvement of aquaporins in colorectal carcinogenesis. Oncogene,2003,22(43):6699-6703.
4.Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002.CA Cancer J Clin,2005 ,55(2):74-108.
5.Bing M,Xiang Y,Li T,et al. Inhibitory effect of topiramate on Lewis lung carcinoma metastasis and its relation with AQP1 water channel.Acta Pharmacol Sin,2004,25(1):54-60.
6.S Saadoun, MC Papadopoulos, DC Davies, et al.Increased aquaporin 1 water channel expression in human brain tumours.Br J Cancer,2002,87(6):621-623.
7.A Mobasheri,R Airley,S Hewitt,et al. Heterogeneous expression of the aquaporin 1 (AQP1) water channel in tumors of the prostate, breast, ovary, colon and lung: a study using high density multiple human tumor tissue microarrays.Int J Oncol,2005,26(5):1149-1158.
8.Saadoun S, Papadopoulos MC, Davies DC, et al. Aquaporin-4 expression is increased in oedematous human brain tumours.J Neurol Neurosurg Psychiatry,2002,72(2):262-265.
9.Carmosino M, Mazzone A, Laforenza U, et al. Altered expression of aquaporin 4 and H(+)/K(+)-ATPase in the stomachs of peptide YY (PYY) transgenic mice.Biol Cell,2005 ,97(9):735-742.
10.Ya Lan Liu, Toshiyuki Matsuzaki, Tadao Nakazawa,et al. Expression of aquaporin 3 (AQP3) in normal and neoplastic lung tissues.Hum Pathol,2007,38(1):171-178.
11.Yang JH, Shi YF, Cheng Q,et al.Expression and localization of aquaporin-5 in the epithelial ovarian tumors.Gynecol Oncol,2006,100(2):294-299.
12.YK Chae,J Woo,MJ Kim,et al.Expression of aquaporin 5 (AQP5) promotes tumor invasion in human non small cell lung cancer.PLoS One,2008,3(5):e2162.
13.Watanabe T, Fujii T, Oya T,et al.Involvement of aquaporin-5 in differentiation of human gastric cancer cells.J Physiol Sci,2009,59(2):113-122.
14.YK Chae,SK Kang,MS Kim,et al.Human AQP5 plays a role in the progression of chronic myelogenous leukemia (CML).PLoS One,2008,3(7):e2594.
15.AS Verkman,M Hara-Chikuma,MC Papadopoulos.Aquaporins--new players in cancer biology.J Mol Med (Berl),2008,86(5):523-529.
cal Guidelines Task Force.Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients.JPEN J Parenter Enteral Nutr,2002,26(1 Suppl):1SA-138SA.
16.石汉平,凌文华,李薇.肿瘤营养学.北京:人民卫生出版社,2012.
17.关兵,董震.水通道蛋白与肿瘤.中国肿瘤临床,2005, 32(13):777-780.







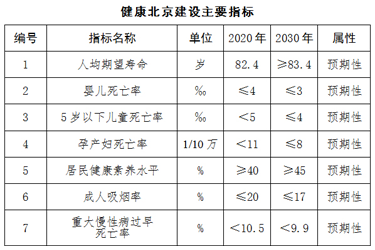
 “健康湖北2030”分析报告发布
“健康湖北2030”分析报告发布



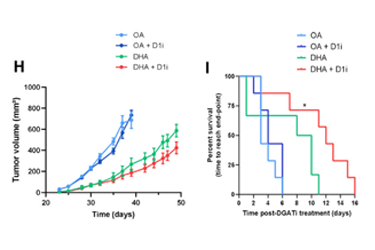









 酸奶与肿瘤临床
酸奶与肿瘤临床 多吃少吃都防癌
多吃少吃都防癌