固有免疫细胞是肿瘤微环境的主要组成部分。它们在调节肿瘤的发生、生长、转移和对治疗的反应中起着复杂而多方面的作用。铁代谢的改变是肿瘤的重要特征之一。流行病学研究表明,铁和铁结合蛋白的增加与肿瘤发生的风险增加有关。2021年2月Wei Liang等人在《Frontiers in Immunology》上发表了题为《Iron Metabolism in the Tumor Microenvironment: Contributions of Innate Immune Cells》的文章,阐述了巨噬细胞和中性粒细胞对肿瘤细胞中铁代谢失调的影响及其对肿瘤生长和转移的影响,并讨论调节巨噬细胞和中性粒细胞作用的机制以及铁代谢对固有免疫细胞表型的影响。现介绍如下:
固有免疫细胞(例如中性粒细胞和巨噬细胞)是宿主抵御入侵病原体的第一道防线,并负责引发炎症反应。肿瘤相关炎症反应是肿瘤的标志之一,并与患者存活率低和治疗效果差相关。既往研究表明,固有免疫细胞如肿瘤相关巨噬细胞(TAM)和中性粒细胞,可以促进肿瘤细胞的生长和转移、诱导肿瘤血管生成、抑制抗肿瘤免疫反应并调节对抗癌疗法的反应。这些复杂的作用是由免疫固有细胞释放的细胞因子、趋化因子、生长因子和酶直接作用于肿瘤细胞和肿瘤微环境(TME)的成分介导,或者通过固有免疫细胞与肿瘤细胞或其它间质细胞之间的细胞接触来介导的。最近的证据表明,募集到TME的固有免疫细胞的代谢具有显著的可塑性。肿瘤细胞可以利用固有免疫细胞和其它基质细胞的代谢副产物来支持肿瘤的生长和促进抗药性。研究固有免疫细胞代谢失调如何影响肿瘤行为可能提供新的治疗途径。
铁是所有生物必不可少的元素。铁被氧化和还原的能力使其非常适合运输电子,并在DNA合成、线粒体呼吸及宿主防御和细胞信号转导等多种生化反应中起辅助因子的作用,并可能导致活性氧(ROS)的形成,从而对基因组稳定性产生不利影响,并可能诱发恶性转化。因此,铁代谢是决定细胞正常和恶性命运的关键因素之一。
肿瘤细胞中的铁代谢
饮食中的铁通过小肠十二指肠细胞上表达的二价金属转运蛋白1(DMT1)吸收进入人体,并通过铁转运蛋白释放到循环中。在体循环中,大部分铁与肝细胞合成的铁转运蛋白又称为转铁蛋白结合。转铁蛋白识别转铁蛋白受体1(Tfr1)或组织特异性转铁蛋白受体2(Tfr2),并通过网格蛋白介导的内吞作用进入细胞。非转铁蛋白结合形式的铁也存在于细胞外液中,并通过不依赖转铁蛋白受体的机制(例如DMT1)被细胞吸收。在内体中,铁从转铁蛋白中解离,被前列腺蛋白(STEAP)的六次跨膜上皮抗原还原,并被DMT1释放到细胞质中,而转铁蛋白受体大部分质膜回收。铁进入细胞后,可能进入线粒体和细胞核,参与一系列生化反应,也可以储存在铁蛋白和不稳定的铁池(LIP)中,或通过铁转运蛋白释放到细胞外。Hepcidin是一种主要由肝脏合成的铁调节肽,直接与铁转运蛋白结合,导致铁转运蛋白的内化和降解并减少铁的释放。细胞内的铁稳态主要通过铁调节蛋白(IRP1和IRP2)与位于与铁代谢有关的靶mRNA的非翻译区(UTR)中的铁响应元件(IRE)的结合来调节。当细胞内铁含量低时,IRP与Tfr1、DMT1、铁蛋白和铁转运蛋白的mRNA的IRE结合,导致Tfr1和DMT1的表达增加,铁蛋白和铁转运蛋白的表达下降。当细胞内铁含量高时,IRPs与IRE分离,从而抑制Tfr1和DMT1的表达,但仍允许铁蛋白和铁转运蛋白的表达。
由于通常恶性肿瘤的增殖率和合成/代谢活性的提高,肿瘤细胞对铁的需求很高。为了确保充足的供应,肿瘤细胞中铁的吸收增多,释放减少。转铁蛋白的合成表现为自分泌机制来支持铁的供应和肿瘤细胞的生长。癌组织中常存在Tfr1的过表达,并与患者生存期较短有关,抑制Tfr1表达显著阻断肿瘤生长和转移。相反,铁转运蛋白在肿瘤细胞中表达降低,并且与较差的患者存活率相关。在不同的肿瘤类型中发现Hepcidin的水平升高,从而限制铁转运蛋白介导的铁转出。此外,IRP2高水平会促进肿瘤细胞的增殖和存活,并与患者的存活率低相关。
TME中的铁水平受固有免疫细胞调节
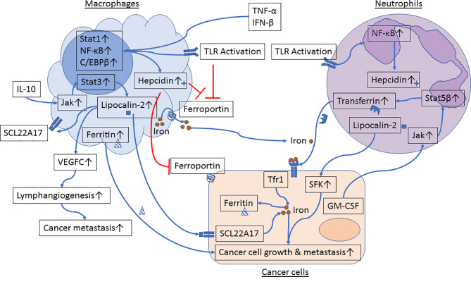
越来越多的证据表明,固有免疫细胞如巨噬细胞和中性粒细胞促进肿瘤细胞中铁代谢失调。驻留在TME中的巨噬细胞和中性粒细胞既可以作为铁和铁相关蛋白的来源(图1),也可以激活肿瘤细胞内控制铁代谢信号通路的释放因子(图2)。
图1 肿瘤细胞与巨噬细胞或中性粒细胞相互作用中的铁代谢
图2 固有免疫细胞控制肿瘤细胞铁代谢的信号
巨噬细胞和中性粒细胞是TME中铁的来源
巨噬细胞是一群具有高可塑性的固有免疫系统细胞,可刺激肿瘤细胞生长、血管生成和转移,抑制抗癌免疫反应,增加治疗抵抗。多种刺激可使巨噬细胞极化为M1(经典激活,促炎)或M2(旁路激活,抑炎)亚型。已有报道巨噬细胞M1亚型高表达铁蛋白,低表达膜铁转运蛋白,而M2巨噬细胞高表达膜铁转运蛋白,低表达铁蛋白。对乳腺癌患者的原发肿瘤组织和腋窝淋巴结的分析显示,乳腺癌细胞表现出以Hepcidin和Tfr1表达增加而铁蛋白表达降低为特征的“铁利用”表型,但原发肿瘤和转移淋巴结中的巨噬细胞表现出以铁蛋白和铁转运蛋白表达增加为特征的“铁供体”表型。
中性粒细胞是人体中最丰富的免疫细胞。肿瘤患者全身循环和肿瘤组织中的中性粒细胞数目升高,并与较差的存活率相关。中性粒细胞可以被肿瘤释放的细胞因子编程,通过作用于肿瘤细胞、内皮细胞以及其他免疫细胞和细胞外基质来发挥促肿瘤功能。中性粒细胞也表达参与铁吸收、存储和转出的蛋白质。铁参与产生氧化爆发或除铁蛋白——lipocalin-2和乳铁蛋白来杀死中性粒细胞吞噬的微生物或限制微生物的生长,在中性粒细胞防御病原体入侵中起着重要作用。然而目前没有直接证据表明中性粒细胞是TME中铁的来源。
巨噬细胞和中性粒细胞是TME中铁相关蛋白的来源
Lipocalin-2是一种急性期蛋白,可以由多种细胞包括上皮细胞、巨噬细胞和中性粒细胞合成。Lipocalin-2与负载铁的细菌或哺乳动物铁载体结合,有两种结局,这可能取决于所处炎症的阶段。在炎症的早期阶段,lipocalin-2与铁-铁载体复合物的结合将铁从细菌中吸收,限制了细菌的生长,从而发挥抗菌功能。另一方面,炎症的消融阶段,可能需要上皮细胞增殖来介导组织修复时,铁-铁载体-lipocalin-2复合物可以充当铁的供体并刺激上皮细胞增殖。
在MCF-7人乳腺癌细胞中,巨噬细胞来源Lipocalin--2诱导增殖、上皮-间质转化和转移性。除肿瘤细胞外,lipocalin-2还可以增强肿瘤相关基质细胞的促肿瘤功能。在另一项研究中,发现lipocalin-2主要在TAM中表达,并充当提供铁的旁分泌因子,从而刺激肿瘤细胞增殖。TAM中的Lipocalin-2缺乏会抑制肿瘤的生长,补充铁可以逆转这种作用。这些结果说明TAM衍生的lipocalin-2是抑制TAM促肿瘤功能的潜在治疗靶标。
转铁蛋白及其受体Tfr1是细胞摄取铁的主要途径。有研究发现,转移性微环境中的转铁蛋白由中性粒细胞而不是肿瘤细胞表达,并且它介导中性粒细胞依赖的促肿瘤细胞有丝分裂作用。在小鼠模型中,耗竭中性粒细胞降低了转移性微环境中转铁蛋白的水平,并抑制了肿瘤转移。这项研究突出了中性粒细胞在调节肿瘤细胞中铁代谢的潜力,并验证了靶向铁代谢阻断中性粒细胞促转移功能治疗策略的可行性。
铁代谢调节信号:来自巨噬细胞和中性粒细胞。
除了直接提供铁和铁相关蛋白外,巨噬细胞和中性粒细胞还可能通过释放作用于肿瘤细胞并诱导调节铁代谢的信号发生变化的细胞因子、趋化因子和生长因子来影响肿瘤细胞中的铁代谢。用TGF-β(一种TAM产生的细胞因子)处理乳腺癌细胞,会降低肿瘤细胞中铁转运蛋白的表达。TAM和中性粒细胞可以表达TNF-α和IL-1β,TNF-α可导致前列腺癌细胞中铁蛋白的表达降低,IL-1β处理肝癌细胞可增加铁蛋白表达。
铁代谢和巨噬细胞极化
铁代谢被认为有助于巨噬细胞极化。据Agoro等人报道,富含铁的饮食诱导小鼠肝脏和腹膜巨噬细胞向M2极化并抑制促炎性M1表型。在培养的巨噬细胞中添加铁可抑制M1共刺激蛋白的表达,并抑制LPS诱导的NF-κB p65核易位以及iNOS、IL-1β、IL-6、IL-12和TNF-α的表达。其他研究也发现铁超载更有利于M2极化而不是M1表型。然而,也有一些相反的结论。有研究报道称,铁处理骨髓源性巨噬细胞可诱导M1标记物的表达并减少IL-4诱导的M2标记物表达。此外,在肿瘤组织中铁染色阳性的肺癌患者的总生存期与M1巨噬细胞标志物高表达有关。这些矛盾的发现说明了铁代谢的情况下巨噬细胞极化的复杂性。
铁调节疗法:不仅仅是铁螯合剂
肿瘤细胞对铁的需求明显增加,表明铁螯合剂可能是一种有效的抗癌策略。临床前研究发现,铁螯合剂抑制了对细胞增殖和存活至关重要的信号通路的激活,并抑制了肿瘤的生长和转移。然而,当在肿瘤患者中进行研究时,这些药物仅显示出适度的治疗益处。在不断努力改善铁螯合剂的生物利用度和联合疗法的同时,需要采取不同的铁调节策略。
固有免疫细胞抑制铁和铁相关蛋白的分泌
尽管肿瘤发生的不同阶段肿瘤细胞急需铁,但系统性改变体内铁的水平以及细胞摄取/储存/利用/输出铁的机制是有害的。作者所在的实验室一直在研究中性粒细胞在肿瘤血管生成以及对VEGF抑制剂的抗血管生成疗法抵抗中的作用,最终将中性粒细胞分泌的转铁蛋白鉴定为促进肿瘤细胞的分裂的主要分子。既往研究发现,IL-10可通过激活Jak / Stat3信号通路诱导巨噬细胞中lipocalin-2表达,增强巨噬细胞的促肿瘤功能。由于Jak / Stat3通路在促进肿瘤细胞增殖、存活和转移、肿瘤血管生成和免疫抑制方面具有多种功能,因此多种Jak激酶或Stat3抑制剂已投入临床治疗肿瘤的研究。
通过铁转运蛋白从巨噬细胞中排出的铁可被TME中的肿瘤细胞摄取。因此,降低TAM中的铁转运蛋白表达水平可能是一种有前途的肿瘤治疗策略。许多研究表明TLR激活可减少膜铁转运蛋白表达,增加巨噬细胞内铁浓度。目前,关于TLR激动剂协调抗癌免疫的能力正在进行临床试验,其抗癌作用主要归因于TLR介导的抗原呈递细胞的成熟和激活以及后续针对肿瘤细胞的适应性免疫应答的激活。在临床前和临床中,TLR激动剂是否能调节TAM的铁供体表型并降低肿瘤细胞中的铁含量,以及这种作用是否有助于其抗癌活性还有待确定。此外,TLR活化诱导巨噬细胞和中性粒细胞铁调素表达,因此TLR激动剂可能会降低铁转运蛋白的表达并诱导铁调素释放作为自分泌/旁分泌因子来进一步抑制巨噬细胞和中性粒细胞铁转运蛋白介导的铁释放,从而“一举两得”。
铁死亡诱导疗法
Ferroptosis是的新发现的一种非凋亡的调节细胞死亡形式,标志是脂质过氧化物的铁依赖累积。高铁水平、抑制谷胱甘肽过氧化物酶4(GPX4)和谷胱甘肽合成、半胱氨酸缺乏、化疗和靶向治疗都可以诱导铁死亡。与正常的癌旁组织相比,肿瘤细胞更容易受铁死亡的影响,推测其原因如下:1)由于铁摄取量的上调和转出机制的下调,肿瘤细胞内铁水平较高 2)由于致癌途径的激活和/或突变,氧化应激在肿瘤细胞中更为严重,增加了TME中代谢活性和缺氧。最近的一项研究发现与肿瘤相关的中性粒细胞诱导了共培养的肿瘤细胞的铁死亡,并在肿瘤组织中引起坏死,导致肿瘤快速进展,缩短了胶质母细胞瘤小鼠的生存期。过表达肿瘤细胞GPX4或沉默ACSL4来抑制铁死亡可减轻中性粒细胞诱导的肿瘤细胞杀伤和坏死,抑制肿瘤的侵袭性并改善小鼠的存活率。
铁超载可在体内和体外诱发巨噬细胞铁死亡。与类似TAM的M2巨噬细胞相比,M1巨噬细胞对铁死亡有更强的抵抗力。因此,铁死亡诱导剂可以选择性地作用于支持肿瘤的TAM,同时保留抑制肿瘤的M1巨噬细胞。GPX4的抑制剂可在包括肿瘤细胞在内的多种细胞中诱导铁死亡。但是,最近的一项研究发现,GPX4缺乏不会影响小鼠巨噬细胞和中性粒细胞的存活,而是诱导髓样细胞氧化应激和H2O2释放,从而触发肠道上皮细胞中的全基因组突变而促进肿瘤发生。这项工作反对单独使用GPX4抑制剂诱导巨噬细胞和中性粒细胞铁死亡。确定肿瘤中TAM和中性粒细胞调节铁死亡的信号传导途径,以及其他治疗方法是否可以通过依赖于铁死亡的机制消除TAM和中性粒细胞仍然需要进一步的研究。
参考文献:
Liang W, Ferrara N. Iron Metabolism in the Tumor Microenvironment: Contributions of Innate Immune Cells. Front Immunol. 2021;11:626812. Published 2021 Feb 12. doi:10.3389/fimmu.2020.626812







 2021中国家庭健康大会在京举行
2021中国家庭健康大会在京举行 《“健康甘肃2030”规划》出台 2030年健康指标达到全国平均水平
《“健康甘肃2030”规划》出台 2030年健康指标达到全国平均水平













 植物油VS动物油,哪个更健康?答案出人意料
植物油VS动物油,哪个更健康?答案出人意料 全谷物是什么?包括哪些?我们应该吃多少?
全谷物是什么?包括哪些?我们应该吃多少?





